O antimônio (Sb), há algum tempo considerado semi-metal, é um metal pertencente ao grupo 15 (o mesmo do nitrogênio) da tabela periódica com número atômico Z = 51 e massa atômica ponderada (levando em consideração os dois únicos isótopos estáveis) A = 121,75 u.
 Nas condições ambiente, é sólido e o alótropo mais estável apresenta coloração metálica branco-azulada (também sendo capaz de formar alótropos ametálicos instáveis de coloração amarela ou escura).
Nas condições ambiente, é sólido e o alótropo mais estável apresenta coloração metálica branco-azulada (também sendo capaz de formar alótropos ametálicos instáveis de coloração amarela ou escura).
Na natureza é dificilmente encontrado sob forma elementar, mas como constituinte de um grande número de minérios.
Propriedades físico-químicas
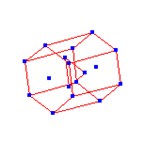 Quando em estado metálico bruto, o antimônio apresenta estrutura cristalina hexagonal de empacotamento compacto (17 átomos dispostos em 6 vértices de cada face hexagonal, com 1 no centro. E mais 3 átomos centrais à estrutura hexaédrica dispostos de forma triangular).
Quando em estado metálico bruto, o antimônio apresenta estrutura cristalina hexagonal de empacotamento compacto (17 átomos dispostos em 6 vértices de cada face hexagonal, com 1 no centro. E mais 3 átomos centrais à estrutura hexaédrica dispostos de forma triangular).
Os estados de oxidação mais comuns observados são -3, +3, +5. Sendo facilmente oxidado na presença de ácidos oxidantes e halogênios (apesar de ser encontrado sob forma de sulfetos).
Não é bom condutor de calor ou eletricidade, e os pontos de fusão e ebulição são próximos de 630°C e 1590°C, respectivamente.
Ocorrência e aplicações
O antimônio está presente na crosta terrestre em concentração média de 1ppm. Mas, apesar de tal baixa distribuição, está presente em centenas de minérios já identificados. Dentre os quais, a antimonita (composta também por enxofre na forma de sulfeto – Sb2S3), sendo também a principal fonte de obtenção desse metal.
Através da combustão da antimonita com oxigênio em excesso, são gerados antimônio elementar e dióxido de carbono (I). Outra forma de extração dá-se pela reação de oxirredução entre o antimônio e o ferro. O primeiro reduz-se e é retirado praticamente puro, enquanto que o segundo liga-se ao íon sulfeto (II).
- (I) 2Sb2O3 + 3C → 4Sb + 3CO2
- (II) Sb2S3 + 3Fe → 2Sb + 3FeS
Assim como outros metais, é utilizado em ligas para que sejam atingidas determinadas propriedades físicas. Além de ser adicionado (sob formas variadas de compostos) a cerâmicas e esmaltes para aumento de resistência pirofórica, na borracha para o processo de vulcanização e na fabricação de fogos de artifício.
Também apresenta funcionalidade na produção de baterias e acumuladores, revestimento de cabos, almofadas, vidros e semicondutores (para a construção de diodos).
Ação biológica
Alguns compostos de antimônio são empregados na formulação de fármacos. Porém, nem todos são inofensivos para a saúde humana: é dito que sua toxicidade depende diretamente da forma pela qual o antimônio se apresenta. Por exemplo, se elementar (Sb), não causa malefício algum caso haja contato direto com este.
Entretanto, a stibnite (o minério constituído por antimônio e enxofre) é altamente tóxica. Assim, diversas medidas de precaução devem ser tomadas para o seu manuseio.
História
O antimônio era conhecido pelos chineses e babilônios desde 3.000 a.C. O sulfeto de antimônio foi empregado como cosmético e com fins medicinais.
A história do símbolo do antimônio, e a sua relação com o seu nome "estíbio", é longa: o nome copta do pó cosmético de sulfeto de antimônio foi tomado do grego e depois passou ao latim, resultando o nome stibium. O químico Jöns Jacob Berzelius usou uma abreviatura deste nome em seus escritos e assim se converteu no símbolo Sb.
Uma teoria para seu nome "stibium" é a de que muitos recipientes que guardavam vinho antigamente continham elementos metálicos com antimônio em sua composição. Este era oxidado e formavam compostos que davam o sabor amargo ao vinho; daí o significado de seu nome: vida azeda.
O antimônio foi amplamente empregado na alquimia. Há escritos sobre este elemento de Georg Bauer (Georgios Agrícola), e Basilio Valentín é o autor de O carro triunfal do antimônio, um tratado sobre o elemento.
Fontes: CPRM




Nenhum comentário:
Postar um comentário